La chimica è la scienza, o più precisamente quel braccio delle scienze naturali, che interpreta e razionalizza la struttura, le proprietà della materia e le sue trasformazioni. Oggetto di studio della chimica sono le proprietà e le strutture dei costituenti della materia, atomi, molecole e altri aggregati, sia da soli che in combinazione tra di loro per produrre i vari stati della materia che formano noi stessi e tutto ciò che ci circonda. Tale studio della materia non è limitato alle sue proprietà e struttura in un dato istante, ma riguarda anche le sue trasformazioni, dette reazioni chimiche. La conoscenza della struttura elettronica degli atomi è alla base della chimica convenzionale, mentre la conoscenza della struttura del nucleo e delle sue trasformazioni spontanee ed indotte è alla base della chimica nucleare. La rottura e la formazione dei legami tra gli atomi e le molecole sono responsabili della trasformazione della materia. La chimica può essere definita come "la scienza centrale" perché connette le altre scienze naturali, come l'astronomia, la fisica, le scienze dei materiali, la biologia e la geologia.

GLI ATOMI E LE MOLECOLE
La materia è formata da particelle elementari chiamate atomi: in natura ne esistono un centinaio di tipi, e ognuno di essi ha struttura e proprietà differenti. Quando gli atomi si combinano fra loro si generano delle molecole. Queste ultime possono essere costituite da atomi tutti uguali fra loro formando quelle che vengono definite sostanze semplici (ad esempio N2, O2, ecc.), mentre le molecole costituite da atomi diversi sono caratteristiche delle sostanze composte (ad esempio H2O, C6H12O6, C12H22O11, H2SO4, ecc.).
Una mole di sostanza risulta costituita da un numero di Avogadro di atomi o molecole (6,022 x 10^23).

LA TAVOLA PERIODICA DEGLI ELEMENTI
La tavola periodica degli elementi è lo schema col quale vengono ordinati gli atomi sulla base del loro numero atomico. La tavola periodica si articola in gruppi e periodi:
•Ogni gruppo (colonne della tabella) comprende gli elementi che hanno la stessa configurazione elettronica esterna (modo in cui gli elettroni si dispongono attorno al nucleo). All'interno di ogni gruppo si trovano elementi con caratteristiche simili.
•Ogni periodo (righe delle tabella) inizia con un elemento il cui atomo ha come configurazione elettronica esterna un elettrone di tipo s, o ns dove n è il numero quantico principale, e procedendo verso gli atomi successivi del periodo, il numero atomico Z aumenta di una unità ad ogni passaggio.

NUMERO ATOMICO, PESO ATOMICO, NUMERO DI MASSA
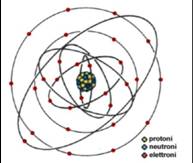
Il numero atomico (indicato solitamente con Z) corrisponde al numero di protoni contenuti in un nucleo atomico. In un atomo neutro il numero atomico è pari anche al numero di elettroni; in caso contrario l'atomo è detto ione.
Ad ogni numero atomico corrisponde un diverso elemento chimico.
Atomi aventi stesso numero atomico ma diverso numero di neutroni sono detti isotopi.
Il peso atomico (indicato spesso con A) o massa atomica è la massa di un atomo di un dato elemento. In questo caso si parla spesso di peso atomico assoluto e viene espresso in grammi. Per ovviare al difficile uso di numeri così piccoli nei calcoli, si è convenuto di esprimere la massa atomica in rapporto al peso atomico assoluto di 1/12 dell'atomo 12C, il cui valore è adottato quale unità di massa atomica (u.m.a.). Questa notazione della massa è nota come peso atomico relativo.
Il peso atomico è legata al numero totale di nucleoni. Il peso reale è leggermente differente perché protoni e neutroni hanno massa diversa (anche se solo del 2 per mille), e perché parte della massa delle particelle costituenti se ne va in energia di legame, riducendo il totale. La massa atomica assoluta è pari alla massa atomica relativa diviso il Numero di Avogadro (6,022 x 10^23).
Il numero di massa (solitamente indicato con A) è pari alla somma delle masse di tutti i protoni e i neutroni presenti in un atomo, siccome le masse di neutroni e protoni sono circa pari a 1 si può dire che il numero di massa sia pari al numero di nucleoni (ovvero protoni e neutroni) contenuti in un nucleo atomico. Nuclidi diversi con lo stesso numero di massa vengono detti isobari.
METALLI, NON METALLI, GAS NOBILI
Si chiamano METALLI gli elementi che, avendo una bassa elettronegatività, perdono facilmente elettroni dall’orbita più esterna. Sono metalli gli elementi dei gruppi 1,2,3 oltre che ai metalli di transizione. Quelli del primo gruppo perdono l’unico elettrone che hanno; quelli del secondo perdono due elettroni e quelli del terzo ne perdono tre. L’atomo si trasforma in IONE POSITIVO dopo aver perduto uno o più elettroni. uUn esempio di metallo è l’atomo di sodio.
I NON METALLI tendono ad acquistare gli elettroni per completare l’ottetto. I non metalli più tipici si trovano nei gruppi V,VI,VII. L’atomo, acquistando uno o più elettroni, si trasforma in IONE NEGATIVO.
•Un esempio di non metallo è l’atomo di cloro che si trova nel VII gruppo acquista l’unico elettrone che manca per formare l’ultimo ottetto.
I LEGAMI CHIMICI
La regola dell’ottetto spinge gli atomi a reagire e a legarsi chimicamente tra loro.
Si chiamano LEGAMI CHIMICI le forze attrattive che tengono uniti gli atomi all’interno delle molecole. Un’importante proprietà di ciascun elemento chimico è la valenza, cioè il numero di legami che un atomo di un elemento stabilisce con atomi di altri elementi per completare l’ultimo ottetto di elettroni. I legami chimici possono essere:
Il legame ionico si ha quando tra due atomi esiste una grande differenza di elettronegatività, l’atomo meno elettronegativo perde elettroni trasformandosi in ione positivo o CATIONE. L’atomo più elettronegativo acquista gli elettroni perduti dal primo e diventa ione negativo o ANIONE.
Il legame covalente si stabilisce tra atoni che, anziché acquistare o cedere elettroni, ne mettono in comune alcuni. Ciò accade quando due atomi hanno una piccola differenza di elettronagatività. In questo caso gli atomi non diventano ioni perché condividono gli elettroni esterni per completare l’ottetto. Vi possono essere legami covalenti:
Semplici (=condivisione di una sola coppia di elettroni);
Doppi (= condivisione di due coppie di elettroni);
Tripli (=condivisione di tre coppie di elettroni).
I COMPOSTI DELL'OSSIGENO
I composti dell'ossigeno sono:
Quando un metallo reagisce con l’ossigeno (reazione di ossidazione), si forma un composto chiamato OSSIDO.
Esempio: Il ferro reagisce con l’ossigeno formando la ruggine (ossido ferrico).
1) Fe+3 + O2-2 = Fe+3O-2
Ora vado a bilanciare le cariche elettriche della mia molecola
2) Fe+3 + O2-2 = Fe2+3O3-2
Ora devo bilanciare la massa.
3) 4Fe + 3O2 = 2Fe2O3
Cioè 4 moli di ferro (224g) reagiscono con 3 moli di ossigeno (96g) e si formano 2 moli di ossido ferrico (320g).
Quando un NON METALLO reagisce con l’ossigeno si forma un composto chiamato
OSSIDI ACIDI O ANIDRIDI.
La reazione del carbonio con l’ossigeno è una combustione.
Quando un ossido reagisce con l’acqua si forma un composto chiamato BASE.
Ecco una reazione…..
MgO + H2O = Mg(OH)2
Qui una molecola di ossido di magnesio reagisce con una mole di acqua per dare una mole di idrossido di magnesio (58 g).
PROPRIETA’ DELLE BASI
La caratteristica delle basi è quella di possedere il gruppo OH- chiamato OSSIDRILE che si comporta come uno ione negativo con carica –1.
LE BASI A CONTATTO CON L’ACQUA SI DISSOCIANO IN IONI OH- E IONI METALLICI +.
Una base si dica forte se si dissocia completamente in ioni.
Quando un’anidride reagisce con l’acqua si forma un composto detto ACIDO.
CO2 reagisce con l’acqua per formare l’acido carbonico (H2CO3).
Esempio: CO2 + H2O = H2CO3
Quando un NON METALLO reagisce con l’idrogeno si forma un composto detto IDRACIDO.
Gli idracidi sono acidi che non contengono ossigeno.
PROPRIETA’ DEGLI ACIDI
Quando gli acidi sono sciolti nell’acqua la loro molecola si dissocia in ione positivo (H+) e ioni negativi, come nel seguente esempio:
HCl in H2O = H +1+ Cl -1
Quando una base reagisce con un acido si forma un composto detto SALE.
Esempio: HCl + NaOH = NaCl + H2O
I Sali sciolti in acqua si dissociano in ioni metallici + e ioni negativi.
Esempio: NaCl in H2O = Na +1 + Cl-1
•Per i Sali ossigenati il nome si ottiene sostituendo il suffisso –OSO dall’acido con il suffisso –ITO;
il suffisso –ICO con il suffisso –ATO.
•Per i Sali non ossigenati si sostituisce al suffisso –IDRICO (es. acido cloridrido) il suffisso –URO
(es. cloruro di sodio).
SOLUZIONI ACIDE, BASICHE E NEUTRE
Le soluzioni possono essere:
Una soluzione si dice ACIDA quando la concentrazione di ioni idrogeno (H+) supera quella degli ioni ossidrile.
Una soluzione si dice BASICA quando la concentrazione di ioni ossidrile supera quella degli ioni idrogeno (H+).
Una soluzione si dice NEUTRA quando la concentrazione di ioni idrogeno (H+) è uguale a quella degli ioni ossidrile (OH-).
COME SI MISURA LA CONCENTRAZIONE DI IONE IDROGENO IN UNA SOLUZIONE?
La concentrazione di ione idrogeno in una soluzione si misura con una grandezza chiamata pH.
Il pH assume valori da 0 a 14.
H+ = OH- neutra pH7
H+ >OH- acida pH compreso fra 1 e 6
H+ < OH- basica pH compreso fra 8 e 14
Gli INDICATORI sono sostanze che cambiano il loro colore secondo il pH della soluzione.